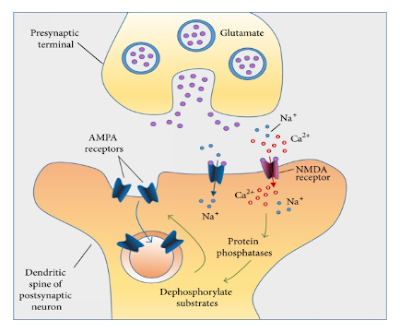
Ictus cerebrale o colpo apoplettico
L’ictus si verifica quando un coagulo di sangue blocca un’arteria cerebrale o quando un’arteria del cervello viene danneggiata e si rompe, provocando interruzione dell'apporto di sangue ossigenato nell'area cerebrale
Ictus è un termine latino che significa “colpo” (in inglese stroke). Insorge, infatti, in maniera improvvisa: una persona in pieno benessere può accusare sintomi tipici che possono essere transitori, restare costanti o peggiorare nelle ore successive.
Quando si verifica un’interruzione dell’apporto di sangue ossigenato in un’area del cervello, si determina la morte delle cellule cerebrali di quell’area. Di conseguenza, le funzioni cerebrali controllate da quell’area (che possono riguardare il movimento di un braccio o di una gamba, il linguaggio, la vista, l’udito o altro) vengono perse.
In Italia l’ictus è la terza causa di morte, dopo le malattie ischemiche del cuore e le neoplasie; causa il 10-12% di tutti i decessi per anno e rappresenta la prima causa di invalidità. Ogni anno si verificano in Italia circa 196.000 ictus, di cui il 20% sono recidive. Il 10-20% delle persone colpite da ictus cerebrale muore entro un mese e un altro 10% entro il primo anno di vita. Solo il 25% dei pazienti sopravvissuti ad un ictus guarisce completamente, il 75% sopravvive con una qualche forma di disabilità, e di questi la metà è portatore di un deficit così grave da perdere l’autosufficienza.
L’ictus è più frequente dopo i 55 anni, la sua prevalenza raddoppia successivamente ad ogni decade ; il 75% degli ictus si verifica nelle persone con più di 65 anni. La prevalenza di ictus nelle persone di età 65-84 anni è del 6,5% (negli uomini 7,4%, nelle donne 5,9%).
La definizione di ictus comprende:
- Ictus ischemico: si verifica quando le arterie cerebrali vengono ostruite dalla graduale formazione di una placca aterosclerotica e/o da un coagulo di sangue, che si forma sopra la placca arteriosclerotica (ictus trombotico) o che proviene dal cuore o da un altro distretto vascolare (ictus trombo-embolico) . Circa l’80% di tutti gli ictus è ischemico.
- Ictus emorragico: si verifica quando un’arteria del cervello si rompe, provocando così un’emorragia intracerebrale non traumatica (questa forma rappresenta il 13% di tutti gli ictus) o caratterizzata dalla presenza di sangue nello spazio sub-aracnoideo (l’aracnoide è una membrana protettiva del cervello; questa forma rappresenta circa il 3% di tutti gli ictus). L’ipertensione è quasi sempre la causa di questa forma gravissima di ictus.
- Attacco ischemico transitorio o TIA, si differenzia dall’ictus ischemico per la minore durata dei sintomi (inferiore alle 24 ore, anche se nella maggior parte dei casi il TIA dura pochi minuti, dai 5 ai 30 minuti). Si stima che il 40% delle persone che presenta un TIA, in futuro andrà incontro ad un ictus vero e proprio.
Sintomi
In un ictus cerebrale, nella maggior parte dei casi si manifestano uno o più dei seguenti sintomi:
- Paralisi improvvisa, disturbi della sensibilità o debolezza, per lo più soltanto a un lato del corpo (volto, braccio o gamba)
- cecità improvvisa (spesso solo un occhio) o visione doppia
- anomalie del linguaggio o difficoltà di capire quanto viene detto
- forte vertigine con incapacità di camminare
- mal di testa improvviso, insolito, fortissimo
I fattori di rischio potenzialmente trattabili:
- Ipertensione cronica (i livelli patologici superano i 120/80 millimetro di mercurio, mmHg)
- Fumo e fumo passivo
- Colesterolo alto
- Diabete
- Obesità e sovrappeso
- Inattività fisica
- Malattie cardiovascolari
- Pillola anticoncezionale e ormonoterapia (a base di estrogeni).
- Eccesso di alcol
- Uso di droghe (cocaina e metamfetamine)
I fattori di rischio non trattabili:
- Età superiore ai 55-60 anni
- Razza: africani, asiatici e caraibici sono i più predisposti
- Storia familiare di ictus, attacco di cuore o TIA
- Sesso. Gli uomini sono più colpiti, rispetto alle donne
- Storia di preeclampsia
Trattamento
- Tramite angio-TC e angio-RM si possono valutare le situazione dei vasi e dei circoli collaterali: soggetto con circoli collaterali funzionanti ha una prognosi migliore poiché ha un compenso migliore e maggiore area di penombra.
Inoltre nell’ischemico, bisogna valutare l’estensione del tessuto necrotico, detto core ischemico, parte non reversibile di ictus anche se riperfuso. Per valutarlo si utilizza la RMN con Sequenza Diffusione che da la possibilità di vedere l’edema citotossico componente intracellulare del core ischemico.
- Tramite TC e RM Perfusionali possiamo valutare la zona di penombra ischemica, ovvero quella parte di tessuto colpito dall’ictus ma ancora salvabile, ma se non si prende per tempo diventa core e quindi irreversibile.
Il trattamento per salvare questo tessuto è detto Fibrinolisi: terapia endovenosa che permette di avere una riapertura del vaso e quindi il danno non si estende.
- Area di restrizione: parte di tessuto dove l’ictus non ha colpito.
Introduzione
L'ictus è la principale causa di disabilità degli adulti in Australia e negli Stati Uniti. Si stima che 7 milioni di adulti americani vivano con un ictus che è costato al sistema sanitario statunitense 33,6 milioni di dollari nel 2011. In Australia, la maggioranza (88%) dei sopravvissuti all'ictus vive nella comunità generale. Tuttavia, di questi sopravvissuti, il 64% ha bisogno di assistenza con l'assistenza sanitaria, il 58% con mobilità e il 47% con l'auto-cura. Questo è un onere significativo per gli individui, le famiglie e gli assistenti e soddisfare queste esigenze di assistenza sarà un problema sostanziale in futuro con l'invecchiamento della popolazione.
La partecipazione all'esercizio, in particolare l'esercizio aerobico, è nota da tempo per avere una vasta gamma di benefici fisici e mentali. Questi includono la riduzione del rischio di malattie cardiovascolari, alcuni tipi di cancro, obesità, ansia e depressione. L'attività fisica regolare e l'esercizio fisico sono anche raccomandati nelle linee guida nazionali per migliorare la funzione fisica e come parte della gestione dei fattori di rischio per la prevenzione secondaria dell'ictus. Più recentemente, tuttavia, sono emerse prove relative ai benefici dell'esercizio delle funzioni cognitive negli adulti sani, con studi che dimostrano una maggiore flessibilità cognitiva, un migliore apprendimento, un migliore controllo esecutivo e una migliore funzione esecutiva, nonché il potenziale per migliorare l'apprendimento motorio. Sta emergendo la prova che l'esercizio fisico può anche migliorare la cognizione nei sopravvissuti allo stroke. Questi benefici cognitivi possono essere, almeno in parte, un risultato dell'esercizio che promuove la neuroplasticità nell'ippocampo, una struttura chiave coinvolta nell'apprendimento e nella memoria.
L'evidenza in adulti più anziani sani suggerisce che livelli più elevati di fitness cardiorespiratorio sono associati a un maggiore volume di materia grigia nell'ippocampo, con diversi studi longitudinali che confermano che l'attività fisica può aumentare il volume della materia grigia. Oltre a questa evidenza di neuroplasticità indotta dall'esercizio nell'ippocampo, vi è una crescente evidenza che l'esercizio aerobico può anche promuovere cambiamenti neuroplastici nella corteccia motoria, e in particolare l'esercizio aerobico a bassa intensità. A causa del ruolo vitale della neuroplasticità nella riacquisizione della funzione e dell'abilità per le persone che hanno subito un ictus, un intervento che promuove la riorganizzazione della corteccia motoria potrebbe avere il potenziale per migliorare gli esiti funzionali e la qualità della vita, nei sopravvissuti allo stroke.
La tecnica cerebrale non invasiva di stimolazione magnetica transcranica (TMS) è un approccio per valutare la neuroplasticità dopo l'ictus. Il TMS stimola la via corticomotoneuronale a conduzione rapida e può essere utilizzato per misurare i cambiamenti nell'efficacia delle connessioni sinaptiche o della plasticità a breve termine nel cervello. Esistono diverse forme di TMS modellato che possono facilitare cambiamenti a lungo termine simili a potenziamento (tipo LTP) a livello corticale. La stimolazione intermittente del theta-burst (iTBS, descritta di seguito) quando applicata in una singola sessione può comportare un aumento transitorio dell'eccitabilità corticale motorio. È stato suggerito che l'applicazione ripetuta di iTBS e di altre tecniche di stimolazione cerebrale non invasiva alla corteccia motoria danneggiata potrebbe migliorare la risposta alla riabilitazione dopo l'ictus, che è stata supportata da uno studio controllato randomizzato, ma non da un altro.
L'obiettivo principale di questo studio era di valutare gli effetti di un singolo ciclo di esercizio aerobico a bassa intensità sulla neuroplasticità nella corteccia motoria di persone che avevano avuto un ictus almeno sei mesi prima. Gli obiettivi secondari erano di indagare se l'esercizio da solo influenzasse l'eccitabilità corticomotoneuronale nei sopravvissuti all'ictus e se l'iTBS da solo influenzasse la neuroplasticità dopo l'ictus.
Metodo
- Partecipanti: Abbiamo reclutato partecipanti di età compresa tra 18 e 80 anni che hanno avuto un ictus almeno sei mesi prima della partecipazione. I partecipanti sono stati reclutati dalla comunità tramite volantini circolati in gruppi di supporto per ictus (in cui vi erano degli esercizi). Sono stati esclusi se avessero avuto problemi cardiaci o di altro tipo che avrebbero impedito loro di svolgere 30 minuti di esercizio ciclico a bassa intensità (ad esempio angina instabile, ipertensione incontrollata, fibrillazione atriale, insufficienza cardiaca), qualsiasi condizione che fosse controindicato per TMS, o nessuna risposta muscolare a TMS (vedi sotto). I partecipanti sono stati esclusi anche se stavano assumendo farmaci beta-bloccanti in quanto ciò avrebbe interferito con la capacità di determinare un'intensità di esercizio adeguata in base alle valutazioni dello sforzo percepito (RPE). Tutti i partecipanti sono stati esaminati dal medico di medicina locale prima della partecipazione allo studio e hanno fornito il consenso scritto e informato. Questo studio è stato approvato dai comitati etici locali e conforme alla Dichiarazione di Helsinki.
- Studio di Progettazione: È stato utilizzato un disegno incrociato randomizzato, soggetto a misure ripetute, con tre condizioni di intervento. Ogni condizione è stata separata da almeno una settimana per prevenire potenziali ripercussioni sull'eccitabilità corticomotoneuronale e per determinare l'ordine delle sessioni di test è stato utilizzato un generatore di numeri casuali. Tutti i test si sono verificati nel pomeriggio per tenere conto delle variazioni diurne nel cortisolo. Ad ogni sessione di test, le misure di base dell'eccitabilità corticale sono state registrate usando TMS. Successivamente, sono state prese misure immediatamente dopo l'esercizio / il riposo ± la stimolazione intermittente theta burst (iTBS, descritta di seguito) e ogni 10 minuti per un totale di 30 minuti. In condizioni che prevedevano l'uso di iTBS, sono state prese misure post-esercizio / condizioni di riposo e pre-applicazione di iTBS. [Vedi Fig 1 per la cronologia degli esperimenti].
- Valutazioni di base / screening: la Forma Breve del Questionario Internazionale sull'Attività Fisica (IPAQ) d è stato utilizzato per monitorare i livelli di attività fisica iniziale dei partecipanti a causa della neuroplasticità corticale motorio potenziata nota per gli individui altamente attivi. L'IPAQ è stato convalidato come indicatore di benessere e fornisce una misura affidabile dell'attività fisica in una varietà di gruppi di età e impostazioni, compreso il post-ictus. Sebbene i partecipanti non siano stati esclusi se hanno partecipato ad alti livelli di attività fisica, l'analisi dell'attività fisica di base è stata considerata nelle analisi. Due ulteriori misure di screening hanno verificato se i partecipanti fossero idonei a sottoporsi a TMS. In primo luogo, è stata completata la schermata TMS per la sicurezza degli adulti per identificare i partecipanti che sarebbero potuto essere esclusi per motivi quali protesi metalliche nella testa, epilessia, ecc. Durante la prima sessione di test, i partecipanti sono stati sottoposti a screening per ottenere l'intero protocollo TMS. Se il TMS non ha indotto un potenziale evocato dal muscolo (MEP) di almeno 0,5 mV, all'80% della massima produzione di stimolatore, i partecipanti sono stati esclusi.
- TMS: L'elettromiografia (EMG) è stata utilizzata per misurare oggettivamente la risposta muscolare alla stimolazione corticale (potenziale evocato motorio o MEP), e quindi l'eccitabilità della proiezione corticomotoneuronale alla mano. I partecipanti erano seduti con il braccio controlaterale al lato del cervello colpito da un ictus che riposava in posizione prona sul loro grembo. La pelle è stata pulita e preparata e gli elettrodi adesivi (Ag / AgCl) sono stati posizionati sul ventre muscolare del primo interosseo dorsale (FDI) e l'articolazione metacarpo-falangea in un montaggio del tendine del ventre per consentire registrazioni EMG di superficie. Il muscolo FDI è stato scelto in quanto è piccolo, localizzato e facilmente identificabile utilizzando la palpazione, oltre a possedere la capacità di ottenere risposte registrabili dal TMS a intensità di stimolazione più basse. Poiché questo muscolo non è coinvolto nell'esercizio ciclico degli arti inferiori, è improbabile che sia influenzato dall'affaticamento che può deprimere l'eccitabilità corticomotoneuronale. Inoltre, è stato stabilito che i cambiamenti nell'eccitabilità corticomotoneuronale, nella neuroplasticità e nell'apprendimento motorio dopo l'esercizio sono evidenti nei muscoli non direttamente coinvolti nell'esercizio. I segnali EMG sono stati amplificati (1000x), filtrati “passa-
banda” (20-1000 Hz), digitalizzati a una frequenza di campionamento di 2000 Hz utilizzando un'interfaccia CED1401 (Cambridge Electronic Design, Cambridge, UK), registrati e memorizzati su un computer per l'analisi offline mediante Signal 4.09 software (Cambridge Electronic Design, Cambridge, UK). Gli impulsi TMS sono stati applicati attraverso una bobina a forma di otto (diametro esterno dell'ala di 90 mm) collegata a uno stimolatore magnetico Magstim 200 (Magstim, Whitland, Regno Unito). La bobina era posizionata tangenzialmente al cranio con la maniglia orientata posteriormente e con un angolo di 45 gradi rispetto alla linea sagittale sulla corteccia motoria. Il sito ottimale del cuoio capelluto (sul lato affetto del cervello colpito) per evocare una risposta nell'FDI rilassato è stato localizzato e contrassegnato usando una penna a punta morbida e determinata per ogni sessione. La bobina è stata tenuta a mano durante l'esperimento e il posizionamento della bobina è stato regolarmente controllato. La soglia del motore è stata determinata in base alle raccomandazioni della Federazione internazionale di neurofisiologia clinica. La soglia del motore a riposo (RMT) è stata definita come la più bassa intensità di stimolazione che evoca MEPs di 0,05 mV nel muscolo FDI rilassato in più di 5 su 10 stimolazioni consecutive. La soglia del motore attiva (AMT) è stata determinata utilizzando una bobina raffreddata ad aria collegata a Magstim Super Rapid (Magstim, Whitland, Regno Unito) per fornire la stimolazione intermittente theta burst (iTBS) e il sito ottimale del cuoio capelluto quando si utilizza questa bobina è stato determinato separatamente e segnato sul cuoio capelluto. L'AMT è stata determinata con il partecipante che mantiene una contrazione isometrica del FDI a circa il 20% della sua massima contrazione volontaria (MVC). L'MVC dell'FDI è stato determinato utilizzando un trasduttore di forza, con un partecipante che produce una forza di presa massima di precisione tra il dito indice e il pollice per 3 secondi. Sono state registrate tre contrazioni massimali, separate da un periodo di riposo di almeno 30 secondi, con il più grande di questi registrato come MVC del partecipante. L'AMT è stata definita come l'intensità di stimolazione più bassa per suscitare i MEP di 0,2 mV in più di 5 su 10 stimolazioni consecutive. I partecipanti sono stati incoraggiati a visualizzare un oscilloscopio durante i test per aiutare a mantenere la forza appropriata per la determinazione della soglia attiva. I cambiamenti nell'eccitabilità della corteccia motoria sono stati misurati indirettamente utilizzando TMS a singolo impulso. Questo è stato eseguito come una misura di base, post esercizio / intervento di riposo, post iTBS (quando consegnato), e a 0 minuti, 10 minuti, 20 minuti e 30 minuti al 120% RMT per valutare qualsiasi stimolazione a lungo termine simile a stimolazione indotta da stimolazione Neuroplasticità (LTP-like) della corteccia motoria dopo iTBS. Ad ogni punto temporale, quindici MEPs sono stati consegnati ad una velocità di ~ 0,2 Hz e registrati. Intermittent TBS (iTBS) è stato consegnato non appena possibile dopo l'esercizio o il riposo. Il paradigma di stimolazione prevedeva tre impulsi ad alta frequenza a bassa intensità (50 Hz) applicati ogni 200 ms per due secondi, quindi ripetuti ogni 10 secondi per un totale di 190 secondi (cioè 600 impulsi). Questo paradigma utilizza una bassa intensità di stimolazione (80% AMT) che è più adatta per i partecipanti al colpo. L'iTBS è stato consegnato utilizzando uno stimolatore magnetico Magstim Super Rapid (Magstim, Whitland, Regno Unito), che è stato applicato al sito ottimale del cuoio capelluto per la stimolazione della corteccia motoria. Le onde M sono state registrate per consentire la normalizzazione delle ampiezze MEP ai cambiamenti nell'ampiezza dell'onda M. Il nervo ulnare è stato stimolato appena prossimale al polso, generando il potenziale muscolare massimo composto all'interno di FDI. Il sito di stimolazione ottimale è stato localizzato usando un elettrodo a barra, prima che gli elettrodi adesivi venissero applicati a questo sito e fissati in posizione con del nastro per il resto dell'esperimento. Gli stimoli sono stati applicati utilizzando uno stimolatore a corrente costante (DS7AH, Digitimer, Welwyn Garden City, Regno Unito). Ogni stimolo era un impulso ad onda quadra di durata 100 μs. L'intensità dell'impulso di stimolazione è stata aumentata fino a quando l'amplificazione dell'onda M ha raggiunto un plateau. L'intensità è stata poi aumentata di un ulteriore 20% per garantire l'ampiezza massima dell'onda M e mantenuta a questo livello per il resto dell'esperimento. Come in precedenza gli studi sull'esercizio hanno dimostrato una diminuzione dell'onda M massima dopo l'esercizio, probabilmente a causa dell'aumento della temperatura corporea. Le onde M sono state registrate in ciascun punto temporale per mantenere le ampiezze normalizzate del MEP. Un totale di cinque onde M di riposo sono state registrate in ciascun punto temporale e le ampiezze da picco a picco sono state calcolate e calcolata una media. Accoppiare impulsi TMS a brevi intervalli di inter-stimolo sotto forma di Short Interval Cortical Inhibition (SICI) è stato utilizzato per studiare i circuiti inibitori. Un impulso di prova sopra-soglia è stato preceduto da un impulso di condizionamento sottosoglia. In precedenza è stato dimostrato che riduce l'ampiezza test MEP a causa dell'attivazione degli interneuroni inibitori di A-mediata dell'acido gamma-ammino butirrico (GABA) nella corteccia motoria primaria. Per valutare questi circuiti intracorticali, sono stati testati due intervalli di inter-stimolo, 2 e 3 millisecondi (rispettivamente SICI2 e SICI3). L'impulso di condizionamento sottosoglia era impostato all'uscita del 5% dello stimolatore sotto AMT e all'impulso di prova suprathreshold al 120% RMT. Per le misurazioni SICI, gli stimoli sono stati applicati allo stesso sito ottimale del cranio, utilizzando una bobina a otto cifre collegata a uno stimolatore di impulsi accoppiati a intervalli programmabili Magstim Bistim 2 (Magstim Co., Whitland, Regno Unito). Questo è stato valutato prima dell'intervento per ottenere un'inibizione intracorticale di base, e quindi a tutti i punti temporali durante l'esperimento. Ad ogni punto del tempo sono stati registrati 30 MEPs con una media di 10 stimoli per stato. SICI è stato quantificato ottenendo l'ampiezza picco-picco del MEP da ogni singolo studio, facendo una media dei MEP di ogni stato, quindi esprimendo la risposta media condizionata come percentuale della risposta incondizionata. - Esercizio Fisico (Exercise intervention): L'esercizio è stato eseguito su un cicloergometro decentrato (Activate Series Recumbent Life- cycle1 Exercise Bike, LifeFitness Australia, Mulgrave, Australia). I partecipanti hanno pedalato con una cadenza di 50 giri al minuto (RPM) per 30 minuti e la resistenza è stata classificata per consentire ai partecipanti di mantenere un RPE di 11-13 (leggero, piuttosto difficile) sulla scala dei punti di 6-20 punti. Questa intensità è stata scelta come esercizio a intensità moderata, nell'ambito delle raccomandazioni aggiornate di recente per i sopravvissuti all'ictus. Ai partecipanti è stato chiesto di mantenere una postura rilassata nella mano che viene valutata per i MEPs durante l'esercizio. Frequenza cardiaca e RPE sono stati registrati ogni cinque minuti durante l'esercizio. La condizione di controllo consisteva nel fatto che i partecipanti rimanevano seduti in posizione seduta per 30 minuti.
- Analisi dei dati: L'analisi dei dati è stata completata offline utilizzando il software Signal. Le prove sono state ispezionate visivamente ed escluse dall'analisi se è stata osservata un'attività muscolare volontaria nei 200 ms precedenti l'artefatto dello stimolo. L'ampiezza picco-picco dei MEP e delle onde M è stata misurata in ciascuna prova ed espressa in mV. Le ampiezze medie di MEP e di onde M sono state calcolate per ciascun partecipante in ciascun momento (linea di base, post intervento, post iTBS (quando applicato), 0 minuti, 10 minuti, 20 minuti e 30 minuti) per ciascuna condizione (i dati grezzi sono forniti come S1 Dataset). L'analisi statistica è stata eseguita utilizzando SPSS Statistics (versione 18.0, SPSS, Chicago, IL). I dati sono stati testati per la normalità utilizzando la statistica di Kolmogorov-Smirnov e trasformati in modo appropriato, se necessario, prima dell'analisi. Analisi di modelli misti lineari con misure ripetute sono state utilizzate per studiare gli effetti degli interventi su MEP, ampiezza dell'onda M e SICI su ciascun punto temporale per le tre condizioni sperimentali.
Lo stesso approccio statistico è stato utilizzato per valutare gli effetti dell'esercizio sulla plasticità simile a LTP confrontando l'iTBS in condizioni di riposo con l'iTBS durante l'esercizio a bassa intensità. La condizione e il tempo sono stati trattati come effetti fissi e ogni soggetto è stato considerato come un effetto casuale. Gli equivalenti metabolici (METs) a settimana, ottenuti dall'IPAQ, sono stati considerati come una covariante. Ulteriori analisi hanno misurato i cambiamenti nell'eccitabilità corticomotoneuronale con l'esercizio aerobico solo analizzando l'effetto del tempo sull'ampiezza del MEP e dell'onda M nella condizione di esercizio a bassa intensità (no iTBS) e la risposta neuroplastica nelle persone a seguito di un ictus da analizzare l'ampiezza di MEP e onde M nel tempo nel resto con la condizione di iTBS. Il livello di significatività è stato impostato a P <0,05 per tutti i confronti e i dati sono mostrati come media ± deviazione standard (SD), salvo diversa indicazione.
Risultati:
Gli interventi sono stati ben tollerati in generale, ma c'è stata una caduta nella prima sessione a causa di capogiri da un'infezione virale, che non era correlata al protocollo dello studio e questi dati non sono stati inclusi nell'analisi. Alcuni partecipanti hanno riferito di dolori muscolari il giorno successivo agli interventi degli esercizi, tuttavia tutti hanno recuperato rapidamente e sono stati in grado di continuare a partecipare. Vedi la Tabella 1 per le caratteristiche dei partecipanti.
1. Onde M: L'analisi di modelli misti dell'ampiezza massima dell'onda M ha rivelato un effetto significativo della condizione (F2,177 = 13,94, P <0,001) ma nessun effetto del tempo (F5,177 = 0,398, P = 0,850) o tempo di condizionamento (F9,177 = 0,370 , P = 0,948). Ciò era dovuto a differenze significative tra le ampiezze onde M durante le tre condizioni (Riposo + iTBS media ampiezza Mmax ± SD 15,7 ± 4,9, Ex solo 13,1 ± 4,6, Ex + iTBS 11,9 ± 26,2). Le ampiezze del MEP sono state quindi normalizzate all'ampiezza Mmax per il resto delle analisi.
- Potenziali motori evocati: Dopo aver normalizzato l'ampiezza MEP su Mmax per ciascun individuo (nMEP), i dati sono stati trasformati in radice quadrata per ottenere una distribuzione normale. Analisi di modelli misti non hanno rivelato alcun effetto significativo del tempo (F5,177 = 0,502, P = 0,774), condizione (F2,177 = 1,187, P = 0,307), o interazione in tempo di condizionamento (F9,177 = 0,584, P = 0,810) su ampiezza nMEP (vedi Fig 2). Queste analisi sono state ripetute con MET / settimana come covariante, senza cambiamenti nei risultati.
- SICI: I dati SICI erano obliqui e veniva eseguita la trasformazione radice quadrata. L'analisi di modelli misti ha mostrato che non vi era alcun effetto significativo del tempo (F5,176 = 0,139, P = 0,98), condizione (F2,176 = 1,930, P = 0,148) o interazione del tempo di condizionamento (F9,176 = 0,422, P = 0,922 ) su SICI2. Allo stesso modo, non vi era alcuna differenza significativa in SICI3 nel tempo (F5,176 = 0,148, P = 0,980), condizione (F2,176 = 0,630, P = 0,534), né un'interazione del tempo di condizionamento (F9,176 = 0,045, P = 1.000).
- Effetto dell’esercizio sulla neuroplasticità : Al fine di confrontare direttamente l'effetto dell'esercizio sulla plasticità simile a LTP indotta da iTBS, abbiamo confrontato gli effetti di Ex + iTBS e Ex solo sull'ampiezza di nMEP. Non ci sono stati effetti significativi di tempo, condizione o tempo di condizionamento nel confrontare queste due condizioni (allP> 0,05). Questi risultati indicano che l'intervento di iTBS da solo non ha comportato un aumento significativo dell'ampiezza di nMEP. Un'ispezione più approfondita di questi dati ha rivelato che vi era una tendenza per le ampiezze di nMEP a diminuire immediatamente dopo il periodo di riposo, con solo un aumento graduale dell'ampiezza del MEP dopo il ritorno di iTBS al valore di pre-riposo (vedi Fig. 3).
- Effetto dell’esercizio da solo sull'eccitabilità corticomotoneuronale: La condizione di solo esercizio è stata anche esaminata individualmente per determinare se il ciclismo degli arti inferiori ha influenzato l'eccitabilità corticomotoneuronale nella mano. L'analisi di modelli misti di dati nMEP normalizzati e trasformati è stata esaminata con il tempo come un effetto fisso. Non c'è stato alcun cambiamento significativo nell'ampiezza dei MEP nel tempo con l'esercizio da solo (F4,51 = 0,605, P = 0,661), vedi Fig 4.
Discussione
Il presente studio indica che 30 minuti di ciclismo a bassa intensità non hanno migliorato la neuroplasticità simile a LTP nella corteccia motoria in individui che erano almeno 6 mesi dopo l'ictus. In questi individui dopo ictus, l'iTBS da solo non induceva una risposta simile a LTP. Inoltre, l'esercizio aerobico non ha avuto effetti significativi sull'eccitabilità corticomotoneuronale.
Questi risultati non supportano il nostro lavoro in giovani adulti sani, che hanno dimostrato che 30 minuti di ciclismo a bassa intensità promuovevano la plasticità indotta da stimolazione. Esistono tre differenze chiave tra gli studi che possono spiegare questi risultati. Innanzitutto, abbiamo utilizzato un diverso paradigma di stimolazione nel presente studio. Piuttosto che usare il TBS continuo (inibitorio), abbiamo scelto di utilizzare l'iTBS (facilitato) in questo studio a causa dei robusti effetti facilitatori nello stadio post ictus acuto e cronico. Sebbene ci sia stata qualche preoccupazione riguardo alla variabilità della risposta con iTBS dal primo rapporto pubblicato da Huang, recenti ricerche hanno supportato l'uso di iTBS come tecnica affidabile per aumentare l'eccitabilità corticale motoria nei giovani adulti. Abbiamo tentato di controllare diversi fattori che possono influenzare la variabilità della risposta (ad esempio ora del giorno, uso di caffeina, storia dell'attività sinaptica) ma abbiamo riscontrato che solo sei dei 12 partecipanti hanno risposto con un aumento dell'eccitabilità dopo l'iTBS, e per molti partecipanti questo era solo transitorio. Quindi la differenza nel paradigma della TBS può spiegare alcune delle nostre scoperte, che l'esercizio non ha migliorato la neuroplasticità indotta dalla stimolazione.
Una seconda differenza chiave tra i due studi è l'età dei partecipanti. Precedenti studi che investicano la riproducibilità dei paradigmi TBS generalmente utilizzano giovani adulti sani, con età medie di 26,7 ± 8,1 e 25,3 ± 8,7. È noto che con l'invecchiamento la capacità di cambiamento neuroplastico tende a diminuire. Data l'età media dei nostri partecipanti era di 65,3 ± 7,8 anni, è probabile che la mancata risposta al paradigma iTBS da sola sia dovuta in parte all'effetto dell'età avanzata. Ciò evidenzia la necessità di stabilire l'efficacia dei paradigmi di stimolazione per indurre la neuroplasticità nei partecipanti più anziani, prima che possano essere applicati in modo affidabile alla popolazione di ictus più anziana.
Infine, i partecipanti al nostro studio hanno avuto un ictus in media due anni prima del loro coinvolgimento nello studio. Mentre l'imaging non è stato possibile ottenere da tutti i partecipanti, in quanto sono stati reclutati dalla comunità. Tutti i partecipanti sono stati in grado di eseguire un MVC con il loro indice interessato, suggerendo che avevano un lieve ictus dell'arteria cerebrale media che li ha lasciati con una debolezza residua della mano minima. Mentre diversi studi che hanno studiato l'effetto di iTBS applicato all'emisfero lesionato nell'ictus cronico, la maggior parte si sono concentrati su esiti clinici come la spasticità o la funzionalità del braccio e pochissimi hanno riscontrato un aumento dell'eccitabilità corticomotoneuronale. In effetti, una revisione di Cochrane che studiava i paradigmi di stimolazione ripetitiva verso gli emisferi affetti o non affetti ha concluso che non vi sono prove sufficienti che la TMS ripetitiva migliori la funzione dopo l'ictus. Sono
necessarie ulteriori ricerche per adattare il sito e il tipo di stimolazione ai singoli sopravvissuti all'ictus, e i nostri risultati suggeriscono che ulteriori ricerche debbano considerare l'impatto dell'età sulla capacità di indurre la plasticità.
I nostri risultati non hanno supportato una diminuzione indotta dall'esercizio dell'ampiezza dell'onda M, probabilmente come risultato di un aumento della temperatura corporea dopo l'esercizio. Invece abbiamo trovato un significativo effetto di condizione, con onde M nel resto con la condizione di iTBS superiore nel complesso. Questa scoperta può essere il risultato di una diminuzione dell'ampiezza delle onde M nelle condizioni che implicano ciclismo a bassa intensità, tuttavia non è stata trovata alcuna interazione significativa tra tempo e trattamento.
Sebbene non sia stata riscontrata alcuna risposta di neuroplasticità a iTBS, si è registrata una tendenza verso un aumento delle dimensioni di nMEP a 10 minuti dopo l'iTBS e 30 minuti dopo l'iTBS. Un'ulteriore analisi dei dati raggruppati ha rilevato un aumento del 12% di nMEP a 30 minuti dopo iTBS. Mentre i calcoli iniziali suggerivano che avevamo bisogno di un aumento del 25% delle dimensioni MEP per rilevare un effetto significativo, questo era alimentato all'80% e attualmente abbiamo solo il 47% di energia per rilevare il cambiamento. I calcoli di potenza post-hoc indicano che avremmo avuto bisogno di 259 partecipanti per rilevare un aumento significativo dell'ampiezza di nMEP tra pre e 30 minuti dopo l'iTBS, con l'80% di potenza nel resto e la condizione di iTBS. Questa piccola dimensione dell'effetto da iTBS, e la mancanza di una tendenza verso l'aumento della taglia MEP dopo aver combinato esercizio e iTBS, suggerisce che questo approccio non è probabilmente clinicamente significativo.
Precedenti studi a supporto dell'uso dell'esercizio per promuovere la neuroplasticità hanno confrontato l'effetto dell'esercizio oltre alla stimolazione cerebrale (ad esempio con stimolazione associativa accoppiata o TBS continua). Tuttavia, se l'esercizio da solo influenza l'eccitabilità corticomotoneuronale non era ancora stato stabilito. Questa potrebbe essere una considerazione importante; se l'esercizio da solo ha un effetto facilitatore o depressivo sull'eccitabilità corticomotoneuronale, allora può interferire con gli interventi successivi. Ad esempio, se l'esercizio dovesse avere un effetto di facilitazione, allora l'effetto simile al LTD di cTBS può essere migliorato (come nel nostro lavoro precedente) attraverso meccanismi di metaplasticità omeostatica. Tuttavia siamo stati in grado di dimostrare nel presente studio con sopravvissuti all'ictus che nessun cambiamento significativo nell'ampiezza del MEP è stato riscontrato nel corso del tempo solo nella condizione di esercizio aerobico.
Ci sono molte limitazioni al presente studio. La dimensione del campione di 12 individui era piccola, ma come detto sopra solo per vedere un cambiamento nella condizione di iTBS da sola avremmo avuto bisogno di una dimensione del campione molto grande. Tuttavia, non c'era una tale tendenza verso un aumento della plasticità simile a LTP con la condizione di esercizio, quindi è improbabile che un campione più ampio influenzi il nostro risultato primario. Non abbiamo studiato gli effetti delle diverse intensità di esercizio, che potrebbero aver rivelato un cambiamento nella neuroplasticità con un esercizio di intensità molto leggero o più vigoroso. Potrebbe essere considerata una limitazione dello studio che non abbiamo incluso una misura funzionale. Precedenti studi che dimostrano i benefici funzionali dei paradigmi TMS raramente hanno trovato una correlazione tra ampiezza e funzione dei MEP, quindi è possibile che i partecipanti possano aver avuto alcuni benefici funzionali dopo l'iTBS che non sono stati catturati in questo studio.
Conclusioni
In questo studio che combina l'esercizio aerobico a bassa intensità e l'iTBS non ha indotto variazioni nell'eccitabilità corticomotorale o neuroplasticità nei partecipanti allo stadio cronico post-ictus. Mentre l'esercizio aerobico dovrebbe rimanere parte integrante dei programmi di riabilitazione dell'ictus per migliorare la forza, la forma fisica e la resistenza e per ridurre la morbilità e la mortalità da ulteriori ictus o altre condizioni croniche, il presente studio non fornisce alcuna prova a sostegno dell'uso di esercizi aerobici durante programmi di riabilitazione dell'ictus per facilitare la neuroplasticità.
Referenze:
AIHW. Stroke and its management in Australia: an update. Canberra: Australian Institute of Health and Welfare, 2013.
Mozaffarian D, Benjamin EJ, Go AS, Arnett DK, Blaha MJ, Cushman M, et al. Heart disease and stroke statistics—2015 update: a report from the American Heart Association. Circulation. 2015; 131(4):e29–322. doi: 10.1161/CIR.0000000000000152 PMID: 25520374.
Langhorne P, Bernhardt J, Kwakkel G. Stroke rehabilitation. Lancet. 2011; 377(9778):1693–702. Epub 2011/05/17. doi: 10.1016/S0140-6736(11)60325-5 PMID: 21571152.
Teasell R, Mehta S, Pereira S, McIntyre A, Janzen S, Allen L, et al. Time to rethink long-term rehabilita- tion management of stroke patients. Top Stroke Rehabil. 2012; 19(6):457–62. Epub 2012/11/30. doi:10.1310/tsr1906-457 PMID: 23192711.
Hillman CH, Erickson KI, Kramer AF. Be smart, exercise your heart: exercise effects on brain and cog- nition. Nat Rev Neurosci. 2008; 9(1):58–65. PMID: 18094706.
Billinger SA, Arena R, Bernhardt J, Eng JJ, Franklin BA, Johnson CM, et al. Physical activity and exer- cise recommendations for stroke survivors: a statement for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 2014; 45(8):2532–53. doi: 10.1161/STR. 0000000000000022 PMID: 24846875.
National Stroke Foundation. Clinical Guidelines for Stroke Rehabilitation and Recovery. Canberra: National Stroke Foundation, 2010.
Masley S, Roetzheim R, Gualtieri T. Aerobic exercise enhances cognitive flexibility. J Clin Psychol Med Settings. 2009; 16(2):186–93. Epub 2009/03/31. doi: 10.1007/s10880-009-9159-6 PMID: 19330430
Mozaffarian D, Benjamin EJ, Go AS, Arnett DK, Blaha MJ, Cushman M, et al. Heart disease and stroke statistics—2015 update: a report from the American Heart Association. Circulation. 2015; 131(4):e29–322. doi: 10.1161/CIR.0000000000000152 PMID: 25520374.
Langhorne P, Bernhardt J, Kwakkel G. Stroke rehabilitation. Lancet. 2011; 377(9778):1693–702. Epub 2011/05/17. doi: 10.1016/S0140-6736(11)60325-5 PMID: 21571152.
Teasell R, Mehta S, Pereira S, McIntyre A, Janzen S, Allen L, et al. Time to rethink long-term rehabilita- tion management of stroke patients. Top Stroke Rehabil. 2012; 19(6):457–62. Epub 2012/11/30. doi:10.1310/tsr1906-457 PMID: 23192711.
Hillman CH, Erickson KI, Kramer AF. Be smart, exercise your heart: exercise effects on brain and cog- nition. Nat Rev Neurosci. 2008; 9(1):58–65. PMID: 18094706.
Billinger SA, Arena R, Bernhardt J, Eng JJ, Franklin BA, Johnson CM, et al. Physical activity and exer- cise recommendations for stroke survivors: a statement for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 2014; 45(8):2532–53. doi: 10.1161/STR. 0000000000000022 PMID: 24846875.
National Stroke Foundation. Clinical Guidelines for Stroke Rehabilitation and Recovery. Canberra: National Stroke Foundation, 2010.
Masley S, Roetzheim R, Gualtieri T. Aerobic exercise enhances cognitive flexibility. J Clin Psychol Med Settings. 2009; 16(2):186–93. Epub 2009/03/31. doi: 10.1007/s10880-009-9159-6 PMID: 19330430
Winter B, Breitenstein C, Mooren FC, Voelker K, Fobker M, Lechtermann A, et al. High impact running improves learning. Neurobiol Learn Mem. 2007; 87(4):597–609. Epub 2006/12/23. doi: S1074-7427 (06)00159-6 [pii] doi: 10.1016/j.nlm.2006.11.003 PMID: 17185007.
Pontifex MB, Hillman CH, Fernhall B, Thompson KM, Valentini TA. The effect of acute aerobic and resistance exercise on working memory. Med Sci Sports Exerc. 2009; 41(4):927–34. Epub 2009/03/12. doi: 10.1249/MSS.0b013e3181907d69 PMID: 19276839.
Colcombe S, Kramer AF. Fitness effects on the cognitive function of older adults: a meta-analytic study. Psychol Sci. 2003; 14(2):125–30. Epub 2003/03/29. PMID: 12661673.
Roig M, Skriver K, Lundbye-Jensen J, Kiens B, Nielsen JB. A single bout of exercise improves motor memory. PLoS One. 2012; 7(9):e44594. doi: 10.1371/journal.pone.0044594 PMID: 22973462; PubMed Central PMCID: PMC3433433.
Statton MA, Encarnacion M, Celnik P, Bastian AJ. A Single Bout of Moderate Aerobic Exercise Improves Motor Skill Acquisition. PLoS One. 2015; 10(10):e0141393. doi: 10.1371/journal.pone. 0141393 PMID: 26506413; PubMed Central PMCID: PMC4624775.
Cumming TB, Tyedin K, Churilov L, Morris ME, Bernhardt J. The effect of physical activity on cognitive function after stroke: a systematic review. Int Psychogeriatr. 2012; 24(4):557–67. doi: 10.1017/ S1041610211001980 PMID: 21996131.
Marzolini S, Oh P, McIlroy W, Brooks D. The effects of an aerobic and resistance exercise training pro- gram on cognition following stroke. Neurorehabil Neural Repair. 2013; 27(5):392–402. doi: 10.1177/ 1545968312465192 PMID: 23161865.
Moore SA, Hallsworth K, Jakovljevic DG, Blamire AM, He J, Ford GA, et al. Effects of Community Exer- cise Therapy on Metabolic, Brain, Physical, and Cognitive Function Following Stroke: A Randomized Controlled Pilot Trial. Neurorehabil Neural Repair. 2015; 29(7):623–35. doi: 10.1177/ 1545968314562116 PMID: 25538152.
Cotman CW, Berchtold NC, Christie LA. Exercise builds brain health: key roles of growth factor cas- cades and inflammation. Trends Neurosci. 2007; 30(9):464–72. Epub 2007/09/04. doi: S0166-2236 (07)00178-6 [pii] doi: 10.1016/j.tins.2007.06.011 PMID: 17765329.
McDonnell MN, Buckley JD, Opie GM, Ridding MC, Semmler JG. A single bout of aerobic exercise pro- motes motor cortical neuroplasticity. J Appl Physiol. 2013; 114(9):1174–82. Epub 2013/03/16. doi: 10. 1152/japplphysiol.01378.2012 [pii]. PMID: 23493367.
Cirillo J, Lavender AP, Ridding MC, Semmler JG. Motor cortex plasticity induced by paired associative stimulation is enhanced in physically active individuals. J Physiol. 2009; 587(Pt 24):5831–42. Epub 2009/10/28. doi: jphysiol.2009.181834 [pii] doi: 10.1113/jphysiol.2009.181834 PMID: 19858227.
Erickson KI, Leckie RL, Weinstein AM. Physical activity, fitness, and gray matter volume. Neurobiol Aging. 2014; 35 Suppl 2:S20–8. doi: 10.1016/j.neurobiolaging.2014.03.034 PMID: 24952993; PubMed Central PMCID: PMC4094356.
Mang CS, Campbell KL, Ross CJ, Boyd LA. Promoting neuroplasticity for motor rehabilitation after stroke: considering the effects of aerobic exercise and genetic variation on brain-derived neurotrophic factor. Phys Ther. 2013; 93(12):1707–16. doi: 10.2522/ptj.20130053 PMID: 23907078; PubMed Cen- tral PMCID: PMC3870490.
Di Lazzaro V, Dileone M, Pilato F, Capone F, Musumeci G, Ranieri F, et al. Modulation of motor cortex neuronal networks by rTMS: comparison of local and remote effects of six different protocols of stimula- tion. J Neurophysiol. 2011; 105(5):2150–6. Epub 2011/02/25. doi: jn.00781.2010 [pii] doi: 10.1152/jn. 00781.2010 PMID: 21346213.
Huang YZ, Edwards MJ, Rounis E, Bhatia KP, Rothwell JC. Theta burst stimulation of the human motor cortex. Neuron. 2005; 45(2):201–6. PMID: 15664172.
Talelli P, Greenwood RJ, Rothwell JC. Exploring Theta Burst Stimulation as an intervention to improve motor recovery in chronic stroke. Clinical Neurophysiology. 2007; 118(2):333–42. PMID: 17166765.
Ackerley SJ, Byblow WD, Barber PA, MacDonald H, McIntyre-Robinson A, Stinear CM. Primed Physi- cal Therapy Enhances Recovery of Upper Limb Function in Chronic Stroke Patients. Neurorehabil Neu- ral Repair. 2015. Epub 2015/07/17. doi: 10.1177/1545968315595285 PMID: 26180053.
Talelli P, Wallace A, Dileone M, Hoad D, Cheeran B, Oliver R, et al. Theta Burst Stimulation in the Rehabilitation of the Upper Limb: A Semirandomized, Placebo-Controlled Trial in Chronic Stroke Patients. Neurorehabil Neural Repair. 2012. Epub 2012/03/14. doi: 1545968312437940 [pii] doi: 10. 1177/1545968312437940 PMID: 22412171.
Snow NJ, Mang CS, Roig M, McDonnell MN, Campbell KL, Boyd LA. The Effect of an Acute Bout of Moderate-Intensity Aerobic Exercise on Motor Learning of a Continuous Tracking Task. PLoS One. 2016; 11(2):e0150039. doi: 10.1371/journal.pone.0150039 PMID: 26901664; PubMed Central PMCID: PMC4764690.
Pontifex MB, Hillman CH, Fernhall B, Thompson KM, Valentini TA. The effect of acute aerobic and resistance exercise on working memory. Med Sci Sports Exerc. 2009; 41(4):927–34. Epub 2009/03/12. doi: 10.1249/MSS.0b013e3181907d69 PMID: 19276839.
Colcombe S, Kramer AF. Fitness effects on the cognitive function of older adults: a meta-analytic study. Psychol Sci. 2003; 14(2):125–30. Epub 2003/03/29. PMID: 12661673.
Roig M, Skriver K, Lundbye-Jensen J, Kiens B, Nielsen JB. A single bout of exercise improves motor memory. PLoS One. 2012; 7(9):e44594. doi: 10.1371/journal.pone.0044594 PMID: 22973462; PubMed Central PMCID: PMC3433433.
Statton MA, Encarnacion M, Celnik P, Bastian AJ. A Single Bout of Moderate Aerobic Exercise Improves Motor Skill Acquisition. PLoS One. 2015; 10(10):e0141393. doi: 10.1371/journal.pone. 0141393 PMID: 26506413; PubMed Central PMCID: PMC4624775.
Cumming TB, Tyedin K, Churilov L, Morris ME, Bernhardt J. The effect of physical activity on cognitive function after stroke: a systematic review. Int Psychogeriatr. 2012; 24(4):557–67. doi: 10.1017/ S1041610211001980 PMID: 21996131.
Marzolini S, Oh P, McIlroy W, Brooks D. The effects of an aerobic and resistance exercise training pro- gram on cognition following stroke. Neurorehabil Neural Repair. 2013; 27(5):392–402. doi: 10.1177/ 1545968312465192 PMID: 23161865.
Moore SA, Hallsworth K, Jakovljevic DG, Blamire AM, He J, Ford GA, et al. Effects of Community Exer- cise Therapy on Metabolic, Brain, Physical, and Cognitive Function Following Stroke: A Randomized Controlled Pilot Trial. Neurorehabil Neural Repair. 2015; 29(7):623–35. doi: 10.1177/ 1545968314562116 PMID: 25538152.
Cotman CW, Berchtold NC, Christie LA. Exercise builds brain health: key roles of growth factor cas- cades and inflammation. Trends Neurosci. 2007; 30(9):464–72. Epub 2007/09/04. doi: S0166-2236 (07)00178-6 [pii] doi: 10.1016/j.tins.2007.06.011 PMID: 17765329.
McDonnell MN, Buckley JD, Opie GM, Ridding MC, Semmler JG. A single bout of aerobic exercise pro- motes motor cortical neuroplasticity. J Appl Physiol. 2013; 114(9):1174–82. Epub 2013/03/16. doi: 10. 1152/japplphysiol.01378.2012 [pii]. PMID: 23493367.
Cirillo J, Lavender AP, Ridding MC, Semmler JG. Motor cortex plasticity induced by paired associative stimulation is enhanced in physically active individuals. J Physiol. 2009; 587(Pt 24):5831–42. Epub 2009/10/28. doi: jphysiol.2009.181834 [pii] doi: 10.1113/jphysiol.2009.181834 PMID: 19858227.
Erickson KI, Leckie RL, Weinstein AM. Physical activity, fitness, and gray matter volume. Neurobiol Aging. 2014; 35 Suppl 2:S20–8. doi: 10.1016/j.neurobiolaging.2014.03.034 PMID: 24952993; PubMed Central PMCID: PMC4094356.
Mang CS, Campbell KL, Ross CJ, Boyd LA. Promoting neuroplasticity for motor rehabilitation after stroke: considering the effects of aerobic exercise and genetic variation on brain-derived neurotrophic factor. Phys Ther. 2013; 93(12):1707–16. doi: 10.2522/ptj.20130053 PMID: 23907078; PubMed Cen- tral PMCID: PMC3870490.
Di Lazzaro V, Dileone M, Pilato F, Capone F, Musumeci G, Ranieri F, et al. Modulation of motor cortex neuronal networks by rTMS: comparison of local and remote effects of six different protocols of stimula- tion. J Neurophysiol. 2011; 105(5):2150–6. Epub 2011/02/25. doi: jn.00781.2010 [pii] doi: 10.1152/jn. 00781.2010 PMID: 21346213.
Huang YZ, Edwards MJ, Rounis E, Bhatia KP, Rothwell JC. Theta burst stimulation of the human motor cortex. Neuron. 2005; 45(2):201–6. PMID: 15664172.
Talelli P, Greenwood RJ, Rothwell JC. Exploring Theta Burst Stimulation as an intervention to improve motor recovery in chronic stroke. Clinical Neurophysiology. 2007; 118(2):333–42. PMID: 17166765.
Ackerley SJ, Byblow WD, Barber PA, MacDonald H, McIntyre-Robinson A, Stinear CM. Primed Physi- cal Therapy Enhances Recovery of Upper Limb Function in Chronic Stroke Patients. Neurorehabil Neu- ral Repair. 2015. Epub 2015/07/17. doi: 10.1177/1545968315595285 PMID: 26180053.
Talelli P, Wallace A, Dileone M, Hoad D, Cheeran B, Oliver R, et al. Theta Burst Stimulation in the Rehabilitation of the Upper Limb: A Semirandomized, Placebo-Controlled Trial in Chronic Stroke Patients. Neurorehabil Neural Repair. 2012. Epub 2012/03/14. doi: 1545968312437940 [pii] doi: 10. 1177/1545968312437940 PMID: 22412171.
Snow NJ, Mang CS, Roig M, McDonnell MN, Campbell KL, Boyd LA. The Effect of an Acute Bout of Moderate-Intensity Aerobic Exercise on Motor Learning of a Continuous Tracking Task. PLoS One. 2016; 11(2):e0150039. doi: 10.1371/journal.pone.0150039 PMID: 26901664; PubMed Central PMCID: PMC4764690.
Vallence AM, Goldsworthy MR, Hodyl NA, Semmler JG, Pitcher JB, Ridding MC. Inter- and intra-sub- ject variability of motor cortex plasticity following continuous theta-burst stimulation. Neuroscience. 2015; 304:266–78. Epub 2015/07/26. doi: 10.1016/j.neuroscience.2015.07.043 PMID: 26208843.
Sale MV, Ridding MC, Nordstrom MA. Cortisol inhibits neuroplasticity induction in human motor cortex. J Neurosci. 2008; 28(33):8285–93. Epub 2008/08/15. doi: 28/33/8285 [pii] doi: 10.1523/JNEUROSCI. 1963-08.2008 PMID: 18701691.
Hagstromer M, Oja P, Sjostrom M. The International Physical Activity Questionnaire (IPAQ): a study of concurrent and construct validity. Public Health Nutr. 2006; 9(6):755–62. Epub 2006/08/24. PMID:16925881.
Fogelholm M, Malmberg J, Suni J, Santtila M, Kyrolainen H, Mantysaari M, et al. International Physical Activity Questionnaire: Validity against fitness. Med Sci Sports Exerc. 2006; 38(4):753–60. doi: 10. 1249/01.mss.0000194075.16960.20 PMID: 16679993.
Craig CL, Marshall AL, Sjostrom M, Bauman AE, Booth ML, Ainsworth BE, et al. International physical activity questionnaire: 12-country reliability and validity. Med Sci Sports Exerc. 2003; 35(8):1381–95. Epub 2003/08/06. doi: 10.1249/01.MSS.0000078924.61453.FB PMID: 12900694.
Cavalcanti P, Campos T, Araujo J. Actigraphic analysis of the sleep-wake cycle and physical activity level in patients with stroke: implications for clinical practice. Chronobiology international. 2012; 29 (9):1267–72. doi: 10.3109/07420528.2012.719960 PMID: 23003002.
Lennon OC, Carey A, Creed A, Durcan S, Blake C. Reliability and validity of COOP/WONCA functional health status charts for stroke patients in primary care. J Stroke Cerebrovasc Dis. 2011; 20(5):465–73. doi: 10.1016/j.jstrokecerebrovasdis.2010.02.020 PMID: 20813545.
Rossi S, Hallett M, Rossini PM, Pascual-Leone A. Safety, ethical considerations, and application guide- lines for the use of transcranial magnetic stimulation in clinical practice and research. Clin Neurophy- siol. 2009; 120(12):2008–39. Epub 2009/10/17. doi: S1388-2457(09)00519-7 [pii] doi: 10.1016/j.clinph. 2009.08.016 PMID: 19833552; PubMed Central PMCID: PMC3260536.
Groppa S, Oliviero A, Eisen A, Quartarone A, Cohen LG, Mall V, et al. A practical guide to diagnostic transcranial magnetic stimulation: report of an IFCN committee. Clin Neurophysiol. 2012; 123(5):858–82. Epub 2012/02/22. doi: 10.1016/j.clinph.2012.01.010 PMID: 22349304.
Zanette G, Bonato C, Polo A, Tinazzi M, Manganotti P, Fiaschi A. Long-lasting depression of motor- evoked potentials to transcranial magnetic stimulation following exercise. Exp Brain Res. 1995; 107 (1):80–6. Epub 1995/01/01. PMID: 8751065.
Mang CS, Snow NJ, Campbell KL, Ross CJ, Boyd LA. A single bout of high-intensity aerobic exercise facilitates response to paired associative stimulation and promotes sequence-specific implicit motor learning. Journal of applied physiology. 2014; 117(11):1325–36. Epub 2014/09/27. doi: 10.1152/ japplphysiol.00498.2014 PMID: 25257866; PubMed Central PMCID: PMC4254838.
Rossini PM, Barker AT, Berardelli A, Caramia MD, Caruso G, Cracco RQ, et al. Non-invasive electrical and magnetic stimulation of the brain, spinal cord and roots: basic principles and procedures for routine clinical application. Report of an IFCN committee. Electroencephalogr Clin Neurophysiol. 1994; 91 (2):79–92. PMID: 7519144.
Di Lazzaro V, Dileone M, Profice P, Pilato F, Cioni B, Meglio M, et al. Direct demonstration that repeti- tive transcranial magnetic stimulation can enhance corticospinal excitability in stroke. Stroke. 2006; 37 (11):2850–3. Epub 2006/09/30. doi: 01.STR.0000244824.53873.2c [pii] doi: 10.1161/01.STR. 0000244824.53873.2c PMID: 17008618.
Dewhurst S, Riches PE, Nimmo MA, De Vito G. Temperature dependence of soleus H-reflex and M wave in young and older women. Eur J Appl Physiol. 2005; 94(5–6):491–9. Epub 2005/06/14. doi: 10. 1007/s00421-005-1384-6 PMID: 15952024.
Ziemann U, Lonnecker S, Steinhoff BJ, Paulus W. Effects of antiepileptic drugs on motor cortex excit- ability in humans: a transcranial magnetic stimulation study. Ann Neurol. 1996; 40(3):367–78. PMID:8797526.
Butefisch CM, Wessling M, Netz J, Seitz RJ, Homberg V. Relationship between interhemispheric inhibi- tion and motor cortex excitability in subacute stroke patients. Neurorehabilitation & Neural Repair. 2008; 22(1):4–21. PMID: 17507644.
Kujirai T, Caramia MD, Rothwell JC, Day BL, Thompson PD, Ferbert A, et al. Corticocortical inhibition in human motor cortex. J Physiol. 1993; 471:501–19. PMID: 8120818.
Borg G. Borg's Perceived Exertion and Pain Scales. Champaign, IL.: Human Kinetics; 1998.
Di Lazzaro V, Profice P, Pilato F, Capone F, Ranieri F, Pasqualetti P, et al. Motor cortex plasticity pre- dicts recovery in acute stroke. Cereb Cortex. 2010; 20(7):1523–8. Epub 2009/10/07. doi: bhp216 [pii] doi: 10.1093/cercor/bhp216 PMID: 19805417.
Sale MV, Ridding MC, Nordstrom MA. Cortisol inhibits neuroplasticity induction in human motor cortex. J Neurosci. 2008; 28(33):8285–93. Epub 2008/08/15. doi: 28/33/8285 [pii] doi: 10.1523/JNEUROSCI. 1963-08.2008 PMID: 18701691.
Hagstromer M, Oja P, Sjostrom M. The International Physical Activity Questionnaire (IPAQ): a study of concurrent and construct validity. Public Health Nutr. 2006; 9(6):755–62. Epub 2006/08/24. PMID:16925881.
Fogelholm M, Malmberg J, Suni J, Santtila M, Kyrolainen H, Mantysaari M, et al. International Physical Activity Questionnaire: Validity against fitness. Med Sci Sports Exerc. 2006; 38(4):753–60. doi: 10. 1249/01.mss.0000194075.16960.20 PMID: 16679993.
Craig CL, Marshall AL, Sjostrom M, Bauman AE, Booth ML, Ainsworth BE, et al. International physical activity questionnaire: 12-country reliability and validity. Med Sci Sports Exerc. 2003; 35(8):1381–95. Epub 2003/08/06. doi: 10.1249/01.MSS.0000078924.61453.FB PMID: 12900694.
Cavalcanti P, Campos T, Araujo J. Actigraphic analysis of the sleep-wake cycle and physical activity level in patients with stroke: implications for clinical practice. Chronobiology international. 2012; 29 (9):1267–72. doi: 10.3109/07420528.2012.719960 PMID: 23003002.
Lennon OC, Carey A, Creed A, Durcan S, Blake C. Reliability and validity of COOP/WONCA functional health status charts for stroke patients in primary care. J Stroke Cerebrovasc Dis. 2011; 20(5):465–73. doi: 10.1016/j.jstrokecerebrovasdis.2010.02.020 PMID: 20813545.
Rossi S, Hallett M, Rossini PM, Pascual-Leone A. Safety, ethical considerations, and application guide- lines for the use of transcranial magnetic stimulation in clinical practice and research. Clin Neurophy- siol. 2009; 120(12):2008–39. Epub 2009/10/17. doi: S1388-2457(09)00519-7 [pii] doi: 10.1016/j.clinph. 2009.08.016 PMID: 19833552; PubMed Central PMCID: PMC3260536.
Groppa S, Oliviero A, Eisen A, Quartarone A, Cohen LG, Mall V, et al. A practical guide to diagnostic transcranial magnetic stimulation: report of an IFCN committee. Clin Neurophysiol. 2012; 123(5):858–82. Epub 2012/02/22. doi: 10.1016/j.clinph.2012.01.010 PMID: 22349304.
Zanette G, Bonato C, Polo A, Tinazzi M, Manganotti P, Fiaschi A. Long-lasting depression of motor- evoked potentials to transcranial magnetic stimulation following exercise. Exp Brain Res. 1995; 107 (1):80–6. Epub 1995/01/01. PMID: 8751065.
Mang CS, Snow NJ, Campbell KL, Ross CJ, Boyd LA. A single bout of high-intensity aerobic exercise facilitates response to paired associative stimulation and promotes sequence-specific implicit motor learning. Journal of applied physiology. 2014; 117(11):1325–36. Epub 2014/09/27. doi: 10.1152/ japplphysiol.00498.2014 PMID: 25257866; PubMed Central PMCID: PMC4254838.
Rossini PM, Barker AT, Berardelli A, Caramia MD, Caruso G, Cracco RQ, et al. Non-invasive electrical and magnetic stimulation of the brain, spinal cord and roots: basic principles and procedures for routine clinical application. Report of an IFCN committee. Electroencephalogr Clin Neurophysiol. 1994; 91 (2):79–92. PMID: 7519144.
Di Lazzaro V, Dileone M, Profice P, Pilato F, Cioni B, Meglio M, et al. Direct demonstration that repeti- tive transcranial magnetic stimulation can enhance corticospinal excitability in stroke. Stroke. 2006; 37 (11):2850–3. Epub 2006/09/30. doi: 01.STR.0000244824.53873.2c [pii] doi: 10.1161/01.STR. 0000244824.53873.2c PMID: 17008618.
Dewhurst S, Riches PE, Nimmo MA, De Vito G. Temperature dependence of soleus H-reflex and M wave in young and older women. Eur J Appl Physiol. 2005; 94(5–6):491–9. Epub 2005/06/14. doi: 10. 1007/s00421-005-1384-6 PMID: 15952024.
Ziemann U, Lonnecker S, Steinhoff BJ, Paulus W. Effects of antiepileptic drugs on motor cortex excit- ability in humans: a transcranial magnetic stimulation study. Ann Neurol. 1996; 40(3):367–78. PMID:8797526.
Butefisch CM, Wessling M, Netz J, Seitz RJ, Homberg V. Relationship between interhemispheric inhibi- tion and motor cortex excitability in subacute stroke patients. Neurorehabilitation & Neural Repair. 2008; 22(1):4–21. PMID: 17507644.
Kujirai T, Caramia MD, Rothwell JC, Day BL, Thompson PD, Ferbert A, et al. Corticocortical inhibition in human motor cortex. J Physiol. 1993; 471:501–19. PMID: 8120818.
Borg G. Borg's Perceived Exertion and Pain Scales. Champaign, IL.: Human Kinetics; 1998.
Di Lazzaro V, Profice P, Pilato F, Capone F, Ranieri F, Pasqualetti P, et al. Motor cortex plasticity pre- dicts recovery in acute stroke. Cereb Cortex. 2010; 20(7):1523–8. Epub 2009/10/07. doi: bhp216 [pii] doi: 10.1093/cercor/bhp216 PMID: 19805417.
Talelli P, Greenwood RJ, Rothwell JC. Exploring Theta Burst Stimulation as an intervention to improve motor recovery in chronic stroke. Clin Neurophysiol. 2007; 118(2):333–42. Epub 2006/12/15. doi: S1388-2457(06)01507-0 [pii] doi: 10.1016/j.clinph.2006.10.014 PMID: 17166765.
Hamada M, Murase N, Hasan A, Balaratnam M, Rothwell JC. The role of interneuron networks in driv- ing human motor cortical plasticity. Cereb Cortex. 2013; 23(7):1593–605. Epub 2012/06/05. doi: 10. 1093/cercor/bhs147 PMID: 22661405.
Hinder MR, Goss EL, Fujiyama H, Canty AJ, Garry MI, Rodger J, et al. Inter- and Intra-individual vari- ability following intermittent theta burst stimulation: implications for rehabilitation and recovery. Brain Stimul. 2014; 7(3):365–71. Epub 2014/02/11. doi: 10.1016/j.brs.2014.01.004 PMID: 24507574.
Freitas C, Perez J, Knobel M, Tormos JM, Oberman L, Eldaief M, et al. Changes in cortical plasticity across the lifespan. Front Aging Neurosci. 2011; 3:5. Epub 2011/04/27. doi: 10.3389/fnagi.2011.00005PMID: 21519394; PubMed Central PMCID: PMC3079175.
Todd G, Kimber TE, Ridding MC, Semmler JG. Reduced motor cortex plasticity following inhibitory rTMS in older adults. Clin Neurophysiol. 2010; 121(3):441–7. doi: 10.1016/j.clinph.2009.11.089 PMID:20071228.
Kim DH, Shin JC, Jung S, Jung TM, Kim DY. Effects of intermittent theta burst stimulation on spasticity after stroke. Neuroreport. 2015; 26(10):561–6. Epub 2015/05/27. doi: 10.1097/WNR. 0000000000000388 PMID: 26011507; PubMed Central PMCID: PMC4498651.
Hao Z, Wang D, Zeng Y, Liu M. Repetitive transcranial magnetic stimulation for improving function after stroke. Cochrane Database Syst Rev. 2013; 5:CD008862. Epub 2013/06/04. doi: 10.1002/14651858. CD008862.pub2 PMID: 23728683.
Bolton CF, Sawa GM, Carter K. The effects of temperature on human compound action potentials. J Neurol Neurosurg Psychiatry. 1981; 44(5):407–13. Epub 1981/05/01. PMID: 7264687; PubMed Central PMCID: PMC490984.
Singh AM, Neva JL, Staines WR. Acute exercise enhances the response to paired associative stimula- tion-induced plasticity in the primary motor cortex. Exp Brain Res. 2014; 232(11):3675–85. Epub 2014/ 08/07. doi: 10.1007/s00221-014-4049-z PMID: 25096384.
Karabanov A, Ziemann U, Hamada M, George MS, Quartarone A, Classen J, et al. Consensus Paper: Probing Homeostatic Plasticity of Human Cortex With Non-invasive Transcranial Brain Stimulation. Brain Stimul. 2015; 8(3):442–54. Epub 2015/06/09. doi: 10.1016/j.brs.2015.01.404 PMID: 26050599.
Rimmer JH, Wang E. Aerobic exercise training in stroke survivors. Top Stroke Rehabil. 2005; 12(1):17–30. doi: 10.1310/L6HG-8X8N-QC9Q-HHM8 PMID: 15735998.
Pedersen BK. The anti-inflammatory effect of exercise: its role in diabetes and cardiovascular disease control. Essays in biochemistry. 2006; 42:105–17. Epub 2006/12/06. doi: 10.1042/bse0420105 PMID:17144883.
Hamada M, Murase N, Hasan A, Balaratnam M, Rothwell JC. The role of interneuron networks in driv- ing human motor cortical plasticity. Cereb Cortex. 2013; 23(7):1593–605. Epub 2012/06/05. doi: 10. 1093/cercor/bhs147 PMID: 22661405.
Hinder MR, Goss EL, Fujiyama H, Canty AJ, Garry MI, Rodger J, et al. Inter- and Intra-individual vari- ability following intermittent theta burst stimulation: implications for rehabilitation and recovery. Brain Stimul. 2014; 7(3):365–71. Epub 2014/02/11. doi: 10.1016/j.brs.2014.01.004 PMID: 24507574.
Freitas C, Perez J, Knobel M, Tormos JM, Oberman L, Eldaief M, et al. Changes in cortical plasticity across the lifespan. Front Aging Neurosci. 2011; 3:5. Epub 2011/04/27. doi: 10.3389/fnagi.2011.00005PMID: 21519394; PubMed Central PMCID: PMC3079175.
Todd G, Kimber TE, Ridding MC, Semmler JG. Reduced motor cortex plasticity following inhibitory rTMS in older adults. Clin Neurophysiol. 2010; 121(3):441–7. doi: 10.1016/j.clinph.2009.11.089 PMID:20071228.
Kim DH, Shin JC, Jung S, Jung TM, Kim DY. Effects of intermittent theta burst stimulation on spasticity after stroke. Neuroreport. 2015; 26(10):561–6. Epub 2015/05/27. doi: 10.1097/WNR. 0000000000000388 PMID: 26011507; PubMed Central PMCID: PMC4498651.
Hao Z, Wang D, Zeng Y, Liu M. Repetitive transcranial magnetic stimulation for improving function after stroke. Cochrane Database Syst Rev. 2013; 5:CD008862. Epub 2013/06/04. doi: 10.1002/14651858. CD008862.pub2 PMID: 23728683.
Bolton CF, Sawa GM, Carter K. The effects of temperature on human compound action potentials. J Neurol Neurosurg Psychiatry. 1981; 44(5):407–13. Epub 1981/05/01. PMID: 7264687; PubMed Central PMCID: PMC490984.
Singh AM, Neva JL, Staines WR. Acute exercise enhances the response to paired associative stimula- tion-induced plasticity in the primary motor cortex. Exp Brain Res. 2014; 232(11):3675–85. Epub 2014/ 08/07. doi: 10.1007/s00221-014-4049-z PMID: 25096384.
Karabanov A, Ziemann U, Hamada M, George MS, Quartarone A, Classen J, et al. Consensus Paper: Probing Homeostatic Plasticity of Human Cortex With Non-invasive Transcranial Brain Stimulation. Brain Stimul. 2015; 8(3):442–54. Epub 2015/06/09. doi: 10.1016/j.brs.2015.01.404 PMID: 26050599.
Rimmer JH, Wang E. Aerobic exercise training in stroke survivors. Top Stroke Rehabil. 2005; 12(1):17–30. doi: 10.1310/L6HG-8X8N-QC9Q-HHM8 PMID: 15735998.
Pedersen BK. The anti-inflammatory effect of exercise: its role in diabetes and cardiovascular disease control. Essays in biochemistry. 2006; 42:105–17. Epub 2006/12/06. doi: 10.1042/bse0420105 PMID:17144883.